Você sabe qual é a diferença entre energia interna, trabalho e calor?
Neste artigo, abordamos os conceitos fundamentais de energia interna e trabalho em um gás termodinâmico, apresentando exemplos de processos de expansão e compressão.
A Física tem a energia como um conceito primitivo fundamental que se manifesta de várias maneiras, como energia mecânica, térmica, elétrica, luminosa, entre outras.
É importante ressaltar que a realização do trabalho pode envolver a conversão ou transmissão de energia, e que o calor é, na verdade, uma forma de energia em trânsito.
Saiba Mais+ O que é a gravidade e como ela age
Introdução a Termodinâmica
Para ilustrar isso, podemos considerar o exemplo de um projétil disparado contra um bloco de madeira. Antes do impacto, o projétil tem energia mecânica (cinética), que é convertida em outras formas de energia, principalmente em energia térmica, após o choque.
Isso se evidencia pelo aquecimento do projétil devido ao aumento da agitação das partículas internas, ou seja, houve a conversão de energia mecânica em energia térmica. Essa conversão é medida pelo trabalho realizado pelas forças que se opuseram à penetração do projétil.
A Termodinâmica é um ramo da Física que estuda as relações entre calor, temperatura, energia e trabalho.
Além disso, a termodinâmica tem como objetivo principal entender como a energia se comporta em sistemas físicos, desde os processos mais simples até os mais complexos.
Um exemplo mais complexo é o de uma usina hidrelétrica, onde a água armazenada em uma barragem é liberada e flui por um tubo em alta velocidade, encontrando as pás de uma turbina.
A água faz as pás da turbina girarem, convertendo sua energia cinética em energia mecânica. Essa energia mecânica é transferida para um gerador, que transforma a energia mecânica em energia elétrica. Nesse processo, a energia cinética da água é convertida em energia elétrica, realizando trabalho.
Em todos os exemplos de conversão de energia, há um sistema físico intermediário que transforma um tipo de energia em outro. No exemplo da usina hidrelétrica, a água é o fluido operante que transforma energia cinética em energia mecânica. Para entender os princípios básicos da Física, utilizamos modelos teóricos, como é o caso da termodinâmica dos gases perfeitos. Nessa situação, o sistema intermediário na conversão de energia térmica em energia mecânica é o modelo teórico do gás perfeito.
Trabalho e Calor Energia Interna
Na Termodinâmica dos Gases Perfeitos, as grandezas físicas fundamentais são a energia interna (U), o trabalho (![]() ) e o calor (Q) associados a uma transformação sofrida pelo gás perfeito. Vamos examinar mais detalhadamente cada uma dessas três grandezas.
) e o calor (Q) associados a uma transformação sofrida pelo gás perfeito. Vamos examinar mais detalhadamente cada uma dessas três grandezas.
Energia interna
A energia interna de um sistema é a soma de todas as formas de energia presentes em suas partículas. Isso inclui a energia cinética de agitação (ou de translação), a energia potencial de agregação, de ligação, nuclear, entre outras. É importante destacar que apenas uma parte dessa energia (a cinética de agitação e a potencial de agregação) é considerada térmica.
continua após a publicidade
Quando fornecemos energia térmica para um corpo ou removemos energia dele, estamos causando uma mudança na sua energia interna. Esse processo pode levar a outras mudanças, como mudanças de fase, variações de pressão e volume, e assim por diante, dependendo das condições em que o sistema se encontra.

A Termodinâmica estuda a relação entre calor, trabalho e energia interna de um sistema. A energia interna de um sistema é a soma de todas as formas de energia das suas partículas, incluindo energia cinética e potencial. Quando fornecemos ou retiramos energia térmica de um corpo, provocamos uma variação na sua energia interna, que é um dos principais parâmetros estudados pela Termodinâmica.
No caso do gás perfeito, suas partículas são esferas com dimensões desprezíveis, o que significa que não existe energia de rotação, nem energia de ligação ou de agregação entre elas. Assim, a energia interna desse sistema é determinada principalmente pela energia cinética de translação das suas partículas, e é calculada pela expressão:
![]()
continua após a publicidade
onde ![]() é a quantidade de matéria,
é a quantidade de matéria, ![]() é a constante universal dos gases e
é a constante universal dos gases e ![]() é a temperatura absoluta. Como a energia interna é função da temperatura absoluta, um aumento de temperatura leva a um aumento na energia interna do gás perfeito. Consequentemente, a variação de energia interna (
é a temperatura absoluta. Como a energia interna é função da temperatura absoluta, um aumento de temperatura leva a um aumento na energia interna do gás perfeito. Consequentemente, a variação de energia interna (![]() ) é sempre positiva (
) é sempre positiva (![]() ).
).
a temperatura aumenta.
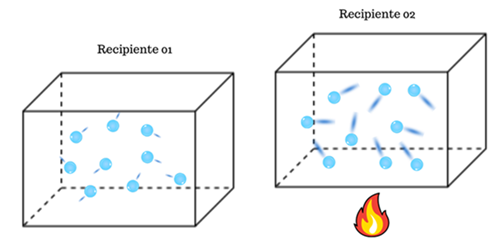
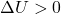 )
)Se houver uma diminuição na temperatura, a energia interna do sistema também diminui, e a sua variação será negativa (![]() ).
).
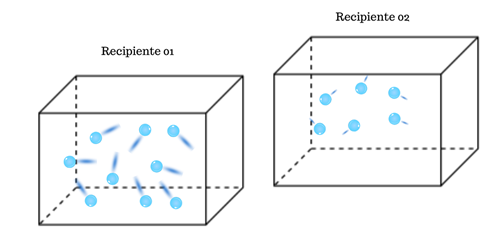
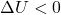 )
)Relacionando a Lei de Joule com a Equação de Clapeyron, podemos escrever:
![]()
![]()
Para gases raros e com apenas um átomo, como o hélio e o neônio, a expressão U = 3/2 nRT é uma boa aproximação da energia interna. No entanto, para gases com moléculas maiores, como o gás carbônico (CO2) e o vapor d’água (H2O), o cálculo da energia interna é mais complexo, pois é necessário levar em conta outras formas de energia, como a energia rotacional e vibracional das moléculas.
SAIBA+ Entenda o que é Frente de Onda e raio de Onda
Trabalho
Na termodinâmica, trabalho é uma forma de transferência de energia entre um sistema e seu entorno, associado a uma força que age através de uma distância. Em outras palavras, é a energia transferida quando uma força é aplicada a um objeto e o objeto se move como resultado dessa força.
Em um sistema termodinâmico, o trabalho é realizado quando há uma mudança de volume do sistema em resposta a uma pressão externa. Por exemplo, quando um gás é comprimido em um cilindro por um pistão, o trabalho é realizado pelo gás para empurrar o pistão e comprimir o gás. Da mesma forma, quando um gás se expande e realiza trabalho, ele empurra o pistão para fora e, assim, transfere energia para o meio externo.
continua após a publicidade
O trabalho realizado em um sistema termodinâmico é uma forma de transferência de energia que pode afetar as propriedades termodinâmicas do sistema, como a temperatura e a pressão. O trabalho também é uma das formas pelas quais a energia pode ser transferida entre um sistema e seu entorno, juntamente com o calor. Ambos são importantes conceitos na termodinâmica para entender a transferência de energia e a dinâmica dos sistemas termodinâmicos.
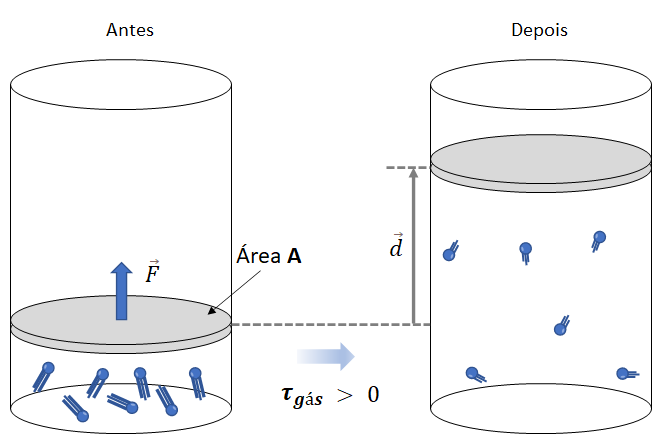
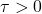 ). O esquema de expansão de um gás perfeito é caracterizado pelo aumento de volume do gás, sendo que o volume final é maior do que o volume inicial
). O esquema de expansão de um gás perfeito é caracterizado pelo aumento de volume do gás, sendo que o volume final é maior do que o volume inicialA força ![]() exercida pelo gás no êmbolo tem a mesma direção do deslocamento
exercida pelo gás no êmbolo tem a mesma direção do deslocamento ![]() sofrido pelo êmbolo. Portanto, o trabalho (
sofrido pelo êmbolo. Portanto, o trabalho (![]() ) realizado por essa força é positivo
) realizado por essa força é positivo ![]()
Quando o ângulo entre a força e o deslocamento é zero, o trabalho realizado é máximo e igual ao produto da magnitude da força pela magnitude do deslocamento. Vejamos agora, a compressão de um gás perfeito.
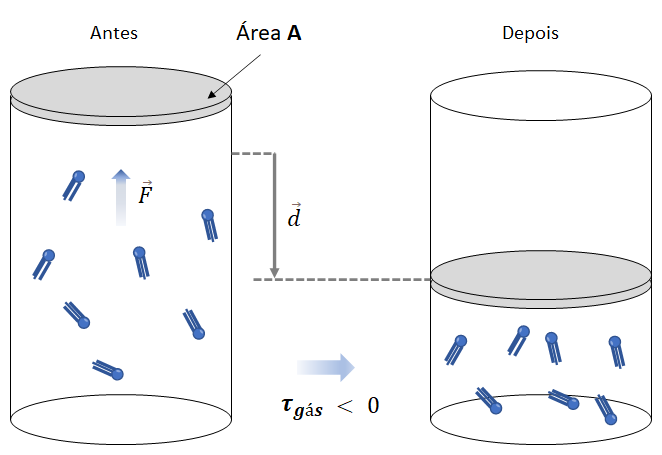
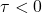 ). O esquema de compressão de um gás perfeito é caracterizado pela redução do volume do gás, sendo que o volume final é menor do que o volume inicial.
). O esquema de compressão de um gás perfeito é caracterizado pela redução do volume do gás, sendo que o volume final é menor do que o volume inicial.A força ![]() exercida pelo gás no êmbolo tem direção oposta ao deslocamento
exercida pelo gás no êmbolo tem direção oposta ao deslocamento ![]() sofrido pelo êmbolo. Portanto, o trabalho (
sofrido pelo êmbolo. Portanto, o trabalho (![]() ) realizado por essa força é negativo
) realizado por essa força é negativo ![]()
Quando o gás não se expande nem é comprimido, ele fica parado e evidentemente não realiza trabalho. Isso significa que a energia interna do gás permanece a mesma e sua temperatura também não muda. Nesse caso, ![]() pois o embolo não se desloca.
pois o embolo não se desloca.
Na expansão, ![]() e o gás fornece energia na forma de trabalho: nesse caso gás realiza trabalho.
e o gás fornece energia na forma de trabalho: nesse caso gás realiza trabalho.
Na compressão, ![]() e o gás recebe energia na forma de trabalho: nesse caso gás recebe trabalho.
e o gás recebe energia na forma de trabalho: nesse caso gás recebe trabalho.
Calor
O calor é definido como a energia térmica que flui de um sistema para outro. Quando ocorre transferência de calor, um dos sistemas cede energia térmica e o outro a recebe. Para convencionar essa transferência, é comum adotar que o calor recebido seja considerado positivo e o calor cedido, negativo.
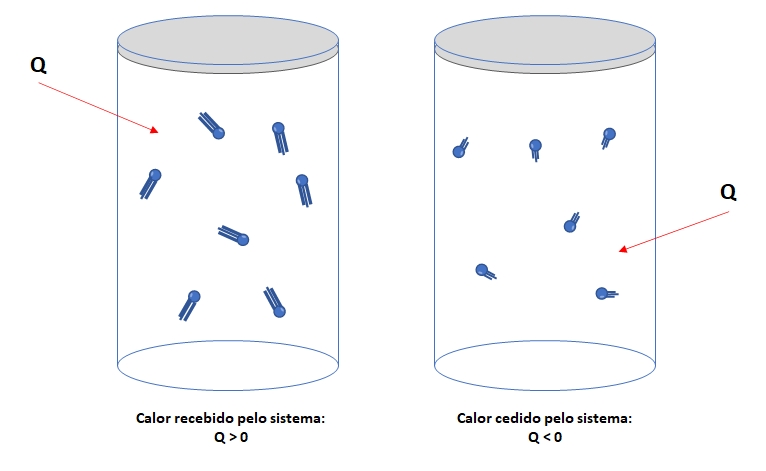
Os sinais atribuídos ao calor recebido e ao calor cedido são essenciais para a correta equação da 1ª Lei da Termodinâmica. É importante destacar que a transferência de energia entre um sistema gasoso e o meio externo pode ocorrer por meio de trabalho realizado ou por trocas de calor.
Referências
Curso de Física Básica: Fluidos, Oscilações e Ondas, Calor (Volume 2)