Você sabe qual é a primeira lei da Termodinâmica?
Neste artigo, iremos explorar o que é a 1ª Lei da Termodinâmica, seus conceitos fundamentais e como ela se aplica na prática.
A Termodinâmica é o ramo da Física que estuda as relações entre a energia térmica, trabalho e as propriedades dos sistemas físicos.
A 1ª Lei da Termodinâmica é uma das leis mais importantes desta área da Física, pois estabelece a relação entre a energia térmica e outras formas de energia, como a energia mecânica.
Lei zero da termodinâmica
A Lei Zero da Termodinâmica é uma das leis fundamentais da Termodinâmica, que trabalha o conceito de equilíbrio térmico. Essa lei estabelece que dois sistemas físicos estão em equilíbrio se, ao serem colocados em contato térmico, não há fluxo de calor entre eles.
Mas o que significa essa condição de equilíbrio térmico e como ela pode ser identificada na prática? A resposta está na diferença de temperatura entre os dois sistemas. Como o fluxo de calor ocorre sempre da região de maior temperatura para a de menor temperatura, quando os dois sistemas estão em equilíbrio térmico, isso indica que suas temperaturas são iguais.
continua após a publicidade
Para entendermos melhor essa lei, é importante compreender que a temperatura é uma medida da energia térmica de um sistema, que pode ser transferida para outro sistema através do calor.
Quando dois sistemas estão em equilíbrio térmico, isso significa que a energia térmica entre eles está equilibrada, ou seja, não há transferência de calor entre eles.
Outra conclusão importante que pode ser obtida a partir da Lei Zero da Termodinâmica é que se dois sistemas físicos, A e B, estão individualmente em equilíbrio térmico com um terceiro sistema C, então ambos estarão em equilíbrio térmico entre si a uma mesma temperatura. Esse conceito pode ser ilustrado pelo seguinte esquema:
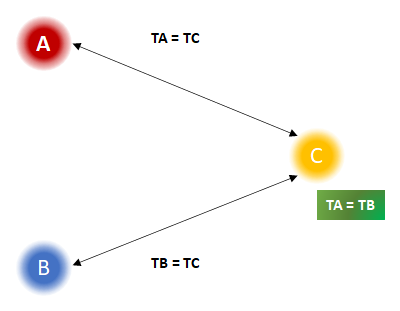
Nesse esquema, os sistemas A e B estão em contato térmico com o sistema C, que funciona como uma espécie de intermediário. Se os sistemas A e B estão em equilíbrio térmico com o sistema C, então isso implica que suas temperaturas são iguais.
Como a temperatura é uma propriedade intensiva, ou seja, não depende do tamanho ou quantidade da amostra, podemos concluir que os sistemas A e B também estão em equilíbrio térmico entre si.
Em resumo, a Lei Zero da Termodinâmica é uma lei fundamental da Termodinâmica que estabelece a condição de equilíbrio térmico entre dois sistemas.
Ela nos permite entender como ocorre a transferência de calor entre sistemas e como podemos identificar a igualdade de temperatura entre eles. Além disso, essa lei é importante para o entendimento de outras leis fundamentais da Termodinâmica, como a 1ª Lei e a Segunda Lei.
1ª Lei da Termodinâmica
A 1ª Lei da Termodinâmica é um princípio fundamental que está relacionado ao conceito de conservação de energia. Essa lei estabelece que a energia total de um sistema isolado permanece constante, ou seja, a energia não pode ser criada ou destruída, apenas transformada de uma forma para outra.
Quando essa lei é aplicada à Termodinâmica, podemos entender o que acontece com um sistema gasoso quando sofre uma transformação termodinâmica, como uma mudança de volume ou temperatura. Através de uma “contabilidade” energética, podemos verificar como a energia do sistema é transformada durante o processo.
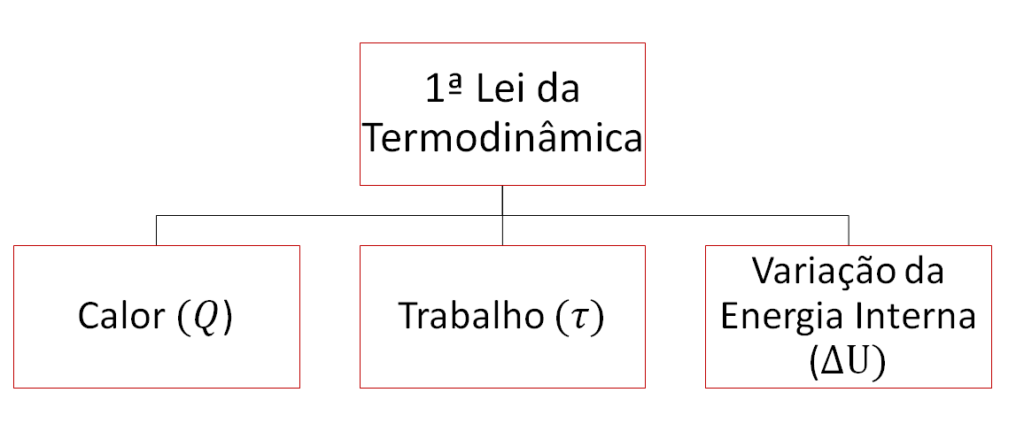
Em sistemas termodinâmicos, a energia interna é uma função característica que está presente em todos os casos. Ela representa a energia total de todas as partículas que compõem o sistema, incluindo sua energia cinética e potencial.
A variação da energia interna (ΔU) entre dois estados quaisquer do sistema é determinada pela diferença entre a quantidade de calor (Q) e o trabalho (![]() ) realizado pelo sistema ou sobre o sistema durante a transformação. Essa relação é conhecida como a 1ª lei da termodinâmica.
) realizado pelo sistema ou sobre o sistema durante a transformação. Essa relação é conhecida como a 1ª lei da termodinâmica.
Matematicamente, pode ser expressa como:
![]()
Vale ressaltar que as grandezas relacionadas à variação da energia interna de um sistema termodinâmico, como a quantidade de calor (Q) e o trabalho (![]() ), podem ter valores positivos, negativos ou nulos, dependendo das condições específicas da transformação.
), podem ter valores positivos, negativos ou nulos, dependendo das condições específicas da transformação.
continua após a publicidade
É possível, por exemplo, que um sistema libere calor para o meio externo, resultando em uma quantidade de calor negativa e uma diminuição na energia interna.
Sinais
Para utilizar a equação, é necessário considerar as seguintes regras de sinais:
![]() positivo se houver aumento na temperatura do sistema;
positivo se houver aumento na temperatura do sistema;
![]() negativo se houver diminuição na temperatura do sistema;
negativo se houver diminuição na temperatura do sistema;
![]() será positivo, se o sistema absorver calor do meio externo;
será positivo, se o sistema absorver calor do meio externo;
![]() será negativo, se o sistema ceder calor ao meio externo;
será negativo, se o sistema ceder calor ao meio externo;
![]() será positivo, se o sistema se expandir, realizando trabalho sobre o meio externo;
será positivo, se o sistema se expandir, realizando trabalho sobre o meio externo;
![]() será negativo, se o sistema se contrair, recebendo trabalho do meio externo.
será negativo, se o sistema se contrair, recebendo trabalho do meio externo.
continua após a publicidade
Exemplos
Vamos revisar o exemplo de aplicação da 1ª Lei da Termodinâmica em um sistema gasoso contido em um recipiente com êmbolo móvel.
- Exemplo 1: Suponha que um gás recebe 1000 cal de calor de uma fonte térmica externa (Q = 1000 cal), causando um aumento de temperatura no gás e a expansão do êmbolo, realizando um trabalho de 600 cal (
 = 600 cal).
= 600 cal).
Com base na 1ª Lei da Termodinâmica, podemos determinar a variação da energia interna (ΔU) do sistema. Sabemos que a variação da energia interna de um sistema é igual à quantidade de calor adicionada (Q) menos o trabalho realizado pelo sistema (![]() ), expresso como:
), expresso como:
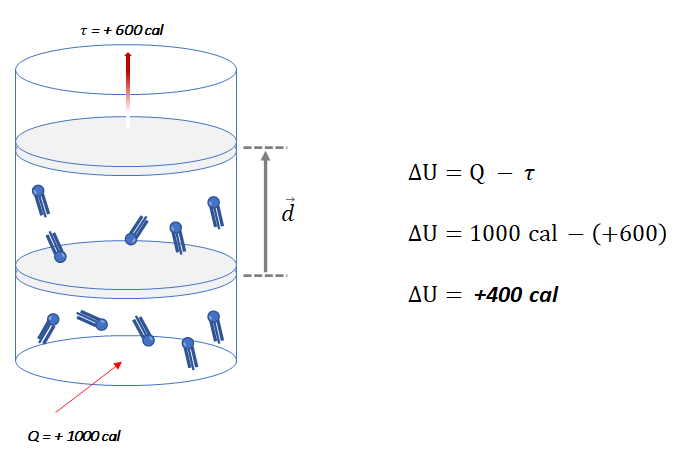
O sinal positivo de ![]() , indica que o sistema sofreu um aumento em sua energia interna.
, indica que o sistema sofreu um aumento em sua energia interna.
Podemos concluir que a energia restante (400 cal) ficou armazenada no sistema gasoso na forma de energia interna, causando um aumento na temperatura do gás. Essa variação de energia interna pode ser calculada pela diferença entre a quantidade de calor fornecida ao sistema e o trabalho realizado por ele.
- Exemplo 2: Suponha que o gás seja comprimido e receba um trabalho igual a 500 J (
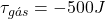 ). Simultaneamente, o gás perde para o ambiente uma quantidade de calor correspondente a 1000 J (Q = -1000 J).
). Simultaneamente, o gás perde para o ambiente uma quantidade de calor correspondente a 1000 J (Q = -1000 J).
Também podemos utilizar o Princípio da Conservação da Energia, o total de energia deve ser conservado. Nesse caso, como o calor cedido pelo sistema é maior em módulo do que a energia recebida em forma de trabalho, concluímos que a diferença de 500 J saiu do próprio sistema, diminuindo sua energia interna (![]() ).
).
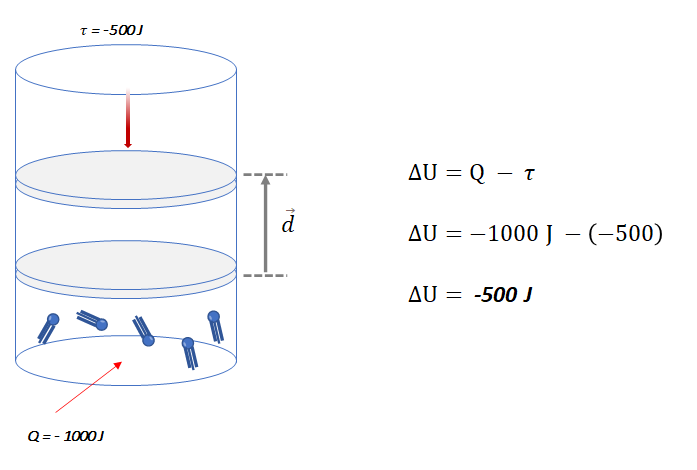
O sinal negativo de ![]() , indica que o sistema sofreu uma diminuição em sua energia interna.
, indica que o sistema sofreu uma diminuição em sua energia interna.
Esses exemplos ilustram como a 1ª Lei da Termodinâmica é aplicada para analisar o comportamento de um sistema gasoso em relação à variação de energia interna, calor e trabalho.
continua após a publicidade
Aplicações da Primeira Lei da Termodinâmica:
- Sistemas de aquecimento e refrigeração: A primeira lei da termodinâmica, também conhecida como o princípio da conservação de energia, é essencial para entender e projetar sistemas de aquecimento e refrigeração. Ela estabelece que a energia não pode ser criada nem destruída, apenas transferida ou transformada. Portanto, ao aplicar essa lei, é possível analisar o fluxo de energia térmica em um sistema, calcular a quantidade de calor trocada e realizar cálculos de eficiência energética.
- Motores térmicos: A primeira lei da termodinâmica é amplamente utilizada no estudo e projeto de motores térmicos, como motores a combustão interna e turbinas a vapor. Esses motores operam com base na transferência de calor para converter energia térmica em trabalho mecânico. A primeira lei é fundamental para analisar a eficiência desses motores, considerando as quantidades de calor fornecidas, trabalho realizado e perdas de energia.
- Processos industriais: A primeira lei da termodinâmica desempenha um papel crucial em diversos processos industriais, como na produção de energia elétrica, refinarias de petróleo, indústrias químicas e siderúrgicas. Ela permite o cálculo de balanços energéticos, o dimensionamento de equipamentos e a otimização dos processos, garantindo a eficiência energética e o controle adequado do fluxo de calor.
- Energias renováveis: A aplicação da primeira lei da termodinâmica é essencial no estudo e desenvolvimento de tecnologias de energia renovável, como painéis solares e turbinas eólicas. Ela auxilia na análise da eficiência dos sistemas de conversão de energia e na maximização do aproveitamento das fontes renováveis disponíveis.
- Climatização e refrigeração de ambientes: A primeira lei da termodinâmica é utilizada na concepção e operação de sistemas de climatização e refrigeração, como ar-condicionado e geladeiras. Ela permite o entendimento da transferência de calor entre o ambiente interno e externo, bem como o cálculo da eficiência energética desses sistemas.
Em resumo, a primeira lei da termodinâmica tem uma ampla gama de aplicações, desde a análise de sistemas de aquecimento e refrigeração até o projeto de motores térmicos e processos industriais.
Além disso, ela desempenha um papel crucial no desenvolvimento de tecnologias de energia renovável e no funcionamento de sistemas de climatização e refrigeração.
Essa lei fundamental permite a compreensão e o controle adequado do fluxo de energia térmica, contribuindo para a eficiência energética e a otimização de processos em diversas áreas.
Referências:
Curso de Física Básica: Fluidos, Oscilações e Ondas, Calor (Volume 2)
Fundamentos da Termodinâmica – por Claus Borgnakke
Gostou? Saiba mais