Qual é a diferença fundamental entre as transformações termodinâmicas isotérmicas, isométricas, isobáricas e adiabáticas?
Neste artigo, vamos abordar os conceitos fundamentais das transformações termodinâmicas: a isotérmica, a isométrica, a isobárica e a adiabática.
As transformações termodinâmicas são caracterizadas por diferentes variações de pressão, volume e temperatura, e pode ser aplicada em diversas áreas da ciência.
Transformações termodinâmicas
Transformação isotérmica
Durante uma transformação isotérmica, a temperatura do sistema gasoso permanece constante. Isso significa que, mesmo com variações na pressão e no volume do gás, a energia interna do sistema permanece inalterada (ΔU = 0).
Esse fato ocorre porque a energia transferida para o gás na forma de calor é exatamente igual à energia perdida pelo gás na realização do trabalho.
continua após a publicidade
Em outras palavras, a quantidade de calor fornecida ao sistema é exatamente convertida em trabalho realizado pelo gás. Isso faz da transformação isotérmica uma das mais importantes em aplicações práticas, pois permite que se realize trabalho sem aumentar a temperatura do sistema. Podemos expressar matematicamente por:
![]()
![]()
Esse fato indica duas possibilidades:
a) Se o sistema gasoso recebe calor (Q > 0), essa energia é integralmente utilizada na realização de trabalho ![]() .
.
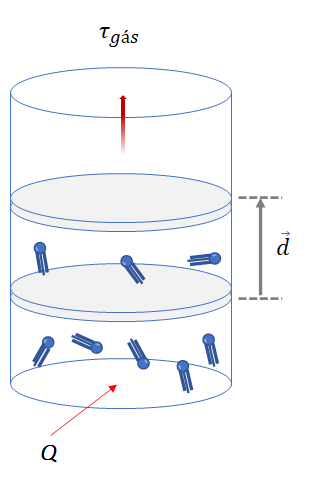
![]()
b) Se o sistema gasoso recebe trabalho ![]() , ele cede para o meio externo igual quantidade de energia em forma de calor (Q < 0).
, ele cede para o meio externo igual quantidade de energia em forma de calor (Q < 0).
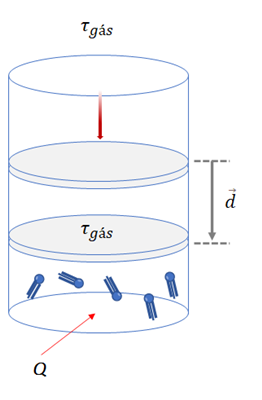
![]()
Lembre-se que, em uma transformação isobárica, a pressão do gás permanece constante, mas o gás troca calor com o meio externo para manter essa pressão constante.
Transformação isométrica
Nas transformações isométricas (também denominadas isovolumétricas, ou ainda, isocóricas), o volume do gás mantém-se constante e, em consequência, o sistema não realiza trabalho (![]() ) nem troca trabalho com o meio externo. Portanto, nesse tipo de transformação o sistema não realiza nem recebe trabalho.
) nem troca trabalho com o meio externo. Portanto, nesse tipo de transformação o sistema não realiza nem recebe trabalho.
Utilizando a equação da 1ª Lei da Termodinâmica, que relaciona a variação da energia interna do sistema (ΔU) com o calor trocado (Q) e o trabalho realizado (![]() ), obtemos:
), obtemos:
![]()
Como não há trabalho realizado na transformação isométrica, toda a energia fornecida na forma de calor é convertida em variação de energia interna do sistema. Portanto, podemos escrever:
![]()
Isso quer dizer que a quantidade de calor que o sistema gasoso recebeu é igual à variação de energia interna do sistema. Em resumo, toda a energia que entrou no sistema na forma de calor foi convertida em energia interna. Temos, então, duas situações a considerar:
a) Se o sistema recebe calor (Q > 0), sua energia interna aumenta (![]() ) em igual valor.
) em igual valor.
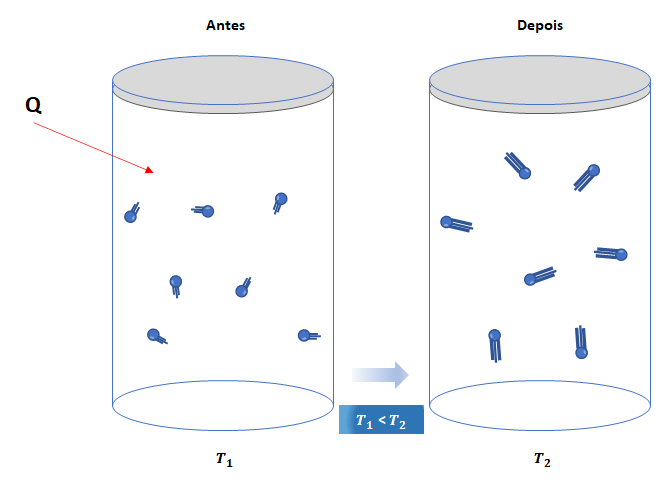
![]()
b) Se o sistema cede calor (![]() ), sua energia interna diminui (
), sua energia interna diminui (![]() ) em igual valor.
) em igual valor.
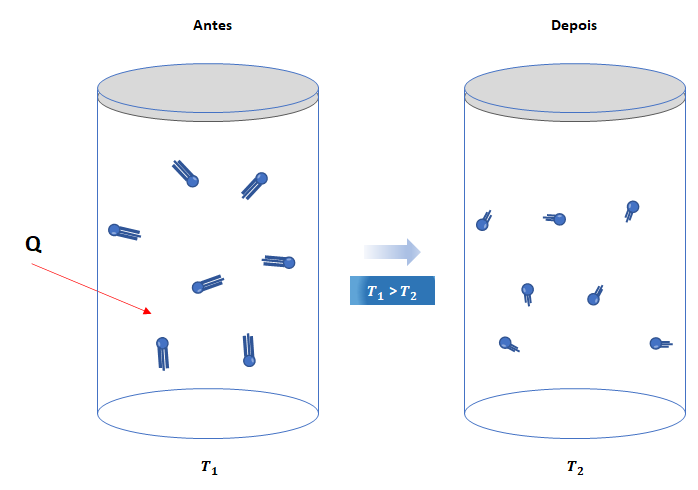
![]()
Lembre-se que, em uma transformação isométrica (ou isocórica), o volume do gás permanece constante, mas o gás troca calor com o meio externo para manter essa condição constante.
Transformação isobárica
Nas transformações isobáricas, a pressão do sistema gasoso é mantida constante. Nesse tipo de transformação, podemos utilizar a Equação de Clapeyron (que é baseada na lei dos gases ideais e é aplicável para gases perfeitos) para analisar o que ocorre:
![]()
Observe que o volume (![]() ) do gás varia diretamente com a temperatura absoluta (
) do gás varia diretamente com a temperatura absoluta (![]() ), pois as outras grandezas permanecem constantes durante essa transformação. Portanto, podemos destacar duas situações importantes a serem consideradas:
), pois as outras grandezas permanecem constantes durante essa transformação. Portanto, podemos destacar duas situações importantes a serem consideradas:
a) Quando a temperatura absoluta do sistema aumenta, o volume do gás também aumenta. Isso significa que a energia interna do sistema aumenta (ou seja, ![]() ), e o sistema realiza trabalho sobre o meio externo (ou seja,
), e o sistema realiza trabalho sobre o meio externo (ou seja, ![]() ). É importante ressaltar que toda essa energia é fornecida ao sistema na forma de calor (
). É importante ressaltar que toda essa energia é fornecida ao sistema na forma de calor (![]() ).
).
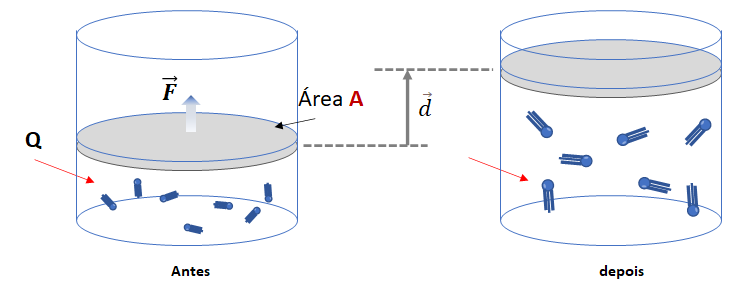
![]()
continua após a publicidade
b) Quando a temperatura absoluta do sistema diminui, o volume do gás também diminui. Isso significa que a energia interna do sistema diminui (ou seja, ![]() ), e o sistema recebe trabalho do meio externo (ou seja,
), e o sistema recebe trabalho do meio externo (ou seja, ![]() ). É importante ressaltar que toda essa energia é liberada pelo sistema na forma de calor (
). É importante ressaltar que toda essa energia é liberada pelo sistema na forma de calor (![]() ) para o meio externo.
) para o meio externo.
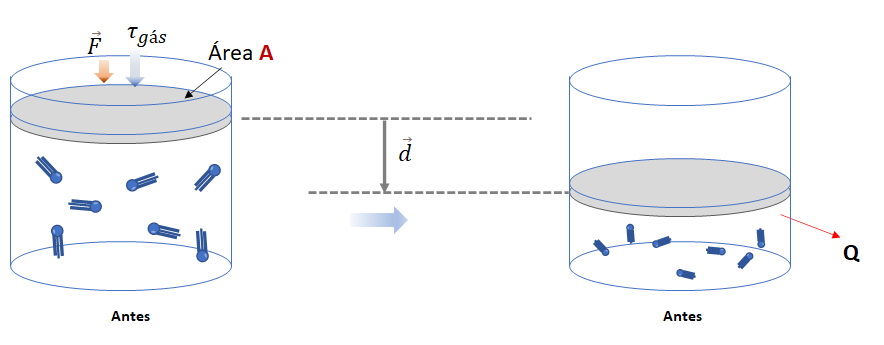
![]()
Lembre-se que, em uma transformação isobárica, a pressão do gás permanece constante, mas o gás troca calor com o meio externo para manter essa pressão constante.
Trabalho de um gás em uma transformação isobárica
Considere um gás em expansão isobárica
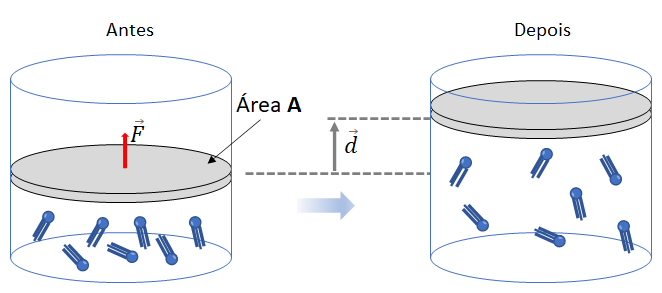
Podemos calcular o trabalho realizado utilizando a fórmula da definição de trabalho para força constante:
![]()
Dessa forma, a equação que representa o trabalho realizado pelo gás em uma transformação isobárica é o produto da pressão (p), que permanece constante, pela variação de volume (![]() ) sofrida pelo gás perfeito:
) sofrida pelo gás perfeito:
![]()
Podemos obter outra expressão para o trabalho utilizando a Equação de Clapeyron, que relaciona a pressão, o volume e a temperatura do gás:
![]()
Essa expressão é válida não somente na expansão isobárica, mas também na compressão isobárica de um gás perfeito.
continua após a publicidade
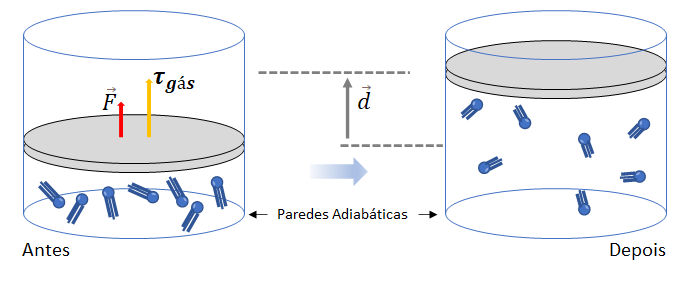
Transformação adiabática
Nas transformações adiabáticas, não há troca de calor entre o sistema e o meio externo. Dessa forma, toda a energia transferida para o sistema ou dele retirada ocorre por meio de trabalho.
Utilizando a equação da Primeira Lei da Termodinâmica, em que Q = 0 para uma transformação adiabática, temos:
![]()
![]()
![]()
Isso implica que a variação de energia interna do sistema é igual, em módulo, ao trabalho realizado pelo sistema sobre o meio externo. Dessa forma, existem duas situações a serem consideradas:
a) Quando o sistema recebe trabalho do gás (![]() ), sua energia interna aumenta (
), sua energia interna aumenta (![]() ) em igual valor.
) em igual valor.
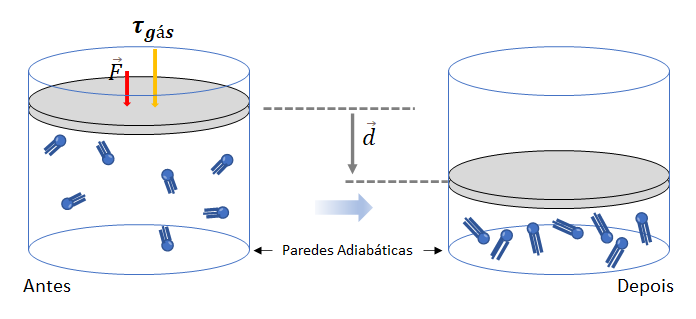
![]()
continua após a publicidade
b) Quando o sistema realiza trabalho sobre o gás (![]() ), ele retira energia de sua própria energia interna, o que resulta em uma diminuição da energia interna do sistema (
), ele retira energia de sua própria energia interna, o que resulta em uma diminuição da energia interna do sistema (![]() ).
).
![]()
Conclusão
Em resumo, as transformações termodinâmicas são processos que envolvem a transferência de energia térmica e trabalho entre o sistema e o meio externo. As leis da termodinâmica são fundamentais para entendermos como esses processos ocorrem e como podemos quantificar as mudanças de estado dos sistemas termodinâmicos.
Cada tipo de transformação termodinâmica possui suas próprias características, que podem ser compreendidas a partir das leis que governam esses processos. Por exemplo, em uma transformação adiabática, não há transferência de calor entre o sistema e o meio externo, enquanto em uma transformação isobárica, a pressão é mantida constante.
continua após a publicidade
Ao estudarmos as transformações termodinâmicas, podemos compreender melhor como os processos naturais e artificiais ao nosso redor ocorrem, como o funcionamento de um motor a combustão ou de uma usina termelétrica. Além disso, esse conhecimento pode ser aplicado em diversas áreas, como na engenharia, na física e na química, para o desenvolvimento de novas tecnologias e soluções para problemas atuais e futuros.
Referências
Curso de Física Básica: Fluidos, Oscilações e Ondas, Calor (Volume 2)