Você qual é a 2ª lei da termodinâmica?
Neste artigo, vamos investigar o funcionamento das máquinas térmicas e a importância da Segunda Lei da Termodinâmica na compreensão de seu desempenho e eficiência.
Por – Redação do Física Curiosa
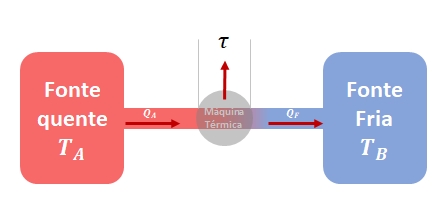
As máquinas térmicas são dispositivos utilizados para converter energia térmica em energia mecânica.
Máquinas Térmicas
Desde as primeiras máquinas térmicas primitivas, que eram empregadas para impulsionar trens, navios e até mesmo os primeiros automóveis, até as mais avançadas e sofisticadas, como um reator termonuclear, todas seguem, em essência, um mesmo princípio de funcionamento.
continua após a publicidade
A conservação da energia é um princípio fundamental da Física que assegura que a energia total de um sistema isolado permanece constante ao longo do tempo.
Aplicando esse princípio às máquinas térmicas, podemos afirmar que a quantidade de calor ![]() fornecida à máquina térmica pela fonte quente, geralmente obtida por meio da combustão de carvão, óleo, madeira ou até mesmo por fissão nuclear em reatores nucleares modernos, é transferida através de um fluido operante, como o vapor de água.
fornecida à máquina térmica pela fonte quente, geralmente obtida por meio da combustão de carvão, óleo, madeira ou até mesmo por fissão nuclear em reatores nucleares modernos, é transferida através de um fluido operante, como o vapor de água.
máquina térmica.
Esse fluido transporta a energia térmica da fonte quente e a direciona para um dispositivo intermediário, onde parte dessa energia é utilizada para realizar trabalho, enquanto o restante é transferido para a fonte fria.
continua após a publicidade
Em conformidade com a conservação da energia, a quantidade de calor ![]() é igual à soma do trabalho realizado pela máquina térmica (
é igual à soma do trabalho realizado pela máquina térmica (![]() ) e da quantidade de calor
) e da quantidade de calor ![]() liberada para a fonte fria:
liberada para a fonte fria:
![]()
Dessa forma, essa equação representa a transferência de energia entre as fontes térmicas e a máquina térmica, onde a energia térmica é parcialmente convertida em trabalho e parte é transferida para a fonte fria.
O trabalho realizado pela máquina térmica é igual à diferença entre os valores absolutos do calor recebido da fonte quente e do calor rejeitado para a fonte fria.
A segunda Lei da Termodinâmica
O rendimento de uma máquina térmica é definido como a razão entre o trabalho realizado e o calor recebido da fonte quente:
![]()
![]()
É importante entender que uma máquina térmica ideal teria um rendimento de 100%, indicado pelo valor de 1. Isso significaria que toda a energia térmica recebida da fonte quente seria convertida em trabalho, e nenhum calor seria rejeitado para a fonte fria (![]() ).
).
continua após a publicidade
No entanto, na prática, alcançar um rendimento de 100% é impossível. Isso ocorre porque a energia térmica (![]() ) só flui da fonte quente para a máquina térmica devido à existência da fonte fria. O calor é uma forma de energia térmica em movimento que se transfere espontaneamente de uma região de maior temperatura para uma de menor temperatura.
) só flui da fonte quente para a máquina térmica devido à existência da fonte fria. O calor é uma forma de energia térmica em movimento que se transfere espontaneamente de uma região de maior temperatura para uma de menor temperatura.
Assim, mesmo em uma máquina térmica ideal, sempre haverá alguma quantidade de calor rejeitada para a fonte fria. Portanto, é impossível alcançar um rendimento perfeito de 100% devido à natureza do fluxo de calor e ao princípio da transferência de energia térmica.
Do reconhecimento dessa limitação, surgiu o enunciado de Kelvin-Planck para a Segunda Lei da Termodinâmica:
É impossível construir uma máquina que, durante seu ciclo operacional, seja capaz de converter totalmente a energia térmica recebida de uma fonte quente em trabalho útil.
Isso significa que, em um sistema fechado, as transformações naturais ocorrem de maneira a aumentar a entropia total do sistema ou, no máximo, mantê-la constante. Isso implica que certos processos, como a transferência de calor de um objeto mais quente para um objeto mais frio (sem trabalho adicional), são irreversíveis.
Essa lei tem implicações significativas para a compreensão dos processos naturais, como a direção espontânea de fluxo de calor, a impossibilidade de alcançar 100% de eficiência em máquinas térmicas e a noção de irreversibilidade dos processos naturais.
Em resumo, a Segunda Lei da Termodinâmica estabelece restrições sobre a direção dos processos termodinâmicos e revela a tendência natural para a desordem e a dissipação de energia no universo.
continua após a publicidade
Aplicações práticas da Segunda Lei da Termodinâmica no dia a dia
A Segunda Lei da Termodinâmica tem aplicações em várias áreas do nosso dia a dia. Como por exemplo:
- Eletrodomésticos: A eficiência energética de aparelhos como refrigeradores, ar-condicionado e aquecedores de água é regida pela Segunda Lei da Termodinâmica. Esses aparelhos operam transferindo calor de uma região mais fria para uma mais quente, consumindo energia para realizar esse trabalho.
- Motores de combustão: Motores de carros, motocicletas e outros veículos utilizam a combustão de combustíveis para gerar trabalho mecânico. No entanto, esses motores nunca alcançam uma eficiência de 100% devido às perdas de energia na forma de calor para a atmosfera.
- Energia térmica: A produção e o uso de energia térmica também são governados pela Segunda Lei da Termodinâmica. A conversão de calor em energia elétrica em usinas termelétricas e a geração de calor em processos industriais devem levar em conta as limitações impostas pela Segunda Lei.
- Eficiência energética: A Segunda Lei da Termodinâmica é uma base fundamental para o desenvolvimento de estratégias de eficiência energética. Ela nos ajuda a entender que nem toda a energia disponível pode ser convertida em trabalho útil e nos incentiva a buscar tecnologias e práticas que minimizem as perdas de energia.
Esses são apenas alguns exemplos do amplo escopo de aplicações da Segunda Lei da Termodinâmica em nosso cotidiano. Ela desempenha um papel importante na engenharia, na indústria, no design de sistemas de energia e em várias outras áreas onde a transferência de calor e a realização de trabalho são relevantes.
continua após a publicidade
o ciclo de Carnot
A descoberta do limite do rendimento de uma máquina térmica foi realizada por Nicolas Léonard Sadi Carnot, um engenheiro francês, no ano de 1824.
Antes desse momento, acreditava-se que uma máquina térmica poderia atingir um rendimento total (100%) ou algo muito próximo desse valor, ou seja, que toda a energia térmica fornecida a uma máquina seria totalmente, ou quase totalmente, convertida em trabalho.
No entanto, Carnot demonstrou a impossibilidade desse rendimento perfeito. Ele propôs um modelo teórico ideal de máquina térmica, que funcionaria seguindo um ciclo específico conhecido como ciclo de Carnot. Esse dispositivo teórico obedece a dois postulados estabelecidos por Carnot, que foram formulados antes mesmo do enunciado da Primeira Lei da Termodinâmica.
continua após a publicidade
1º Postulado de Carnot
Nenhuma máquina térmica, operando entre duas temperaturas fixas, pode ter um rendimento maior do que uma máquina térmica ideal de Carnot operando entre essas mesmas temperaturas.
Esse princípio é uma consequência direta da Segunda Lei da Termodinâmica e impõe um limite superior para a eficiência das máquinas térmicas reais.
Isso significa que sempre haverá perdas de energia na forma de calor durante o processo de conversão, e essas perdas limitam o rendimento máximo que uma máquina térmica pode alcançar.
2º postulado de Carnot
Ao operar entre duas temperaturas fixas, a máquina ideal de Carnot tem o mesmo rendimento, independentemente do tipo de fluido utilizado.
Isso significa que, para uma diferença de temperatura dada entre a fonte quente e a fonte fria, a eficiência da máquina de Carnot será a mesma, não importando qual seja o fluido utilizado como meio de trabalho. Essa característica da máquina de Carnot é única e diferenciada em relação às máquinas térmicas reais.
Essa conclusão é fundamental para entender as limitações intrínsecas das máquinas térmicas e ressaltar a importância do ciclo de Carnot como uma referência para a eficiência máxima alcançável.
continua após a publicidade
Esses postulados são de fundamental importância para entender os princípios básicos da termodinâmica e a limitação intrínseca da conversão total de energia térmica em trabalho útil.
A contribuição de Carnot estabeleceu as bases para o desenvolvimento posterior das leis termodinâmicas e teve um impacto significativo no campo da engenharia e na compreensão dos processos energéticos.
É importante observar que esses postulados estabelecem que o rendimento de uma máquina térmica depende das temperaturas das fontes fria e quente. No entanto, quando mantemos as temperaturas dessas fontes fixas, a máquina teórica de Carnot é a que alcançaria o rendimento máximo possível.
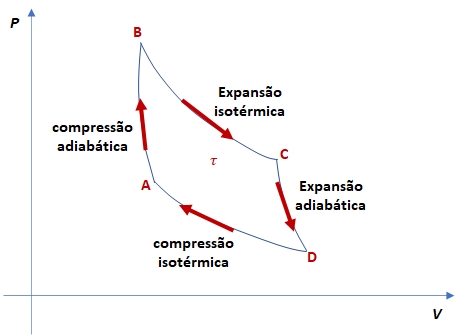
No caso específico em que o fluido operante é o gás perfeito, o ciclo de Carnot é composto por duas transformações isotérmicas (mantendo a temperatura constante) e duas transformações adiabáticas (sem troca de calor com o ambiente), intercaladas entre as isotermas.
duas isotermas e duas adiabáticas.
Na etapa de expansão isotérmica BC, o sistema realiza trabalho ao mesmo tempo em que absorve calor ![]() da fonte quente. Já na etapa de expansão adiabática CD, o sistema não troca calor com o ambiente. Nessa etapa, ocorre apenas a realização de trabalho, resultando em uma diminuição da energia interna e, consequentemente, da temperatura.
da fonte quente. Já na etapa de expansão adiabática CD, o sistema não troca calor com o ambiente. Nessa etapa, ocorre apenas a realização de trabalho, resultando em uma diminuição da energia interna e, consequentemente, da temperatura.
continua após a publicidade
Na etapa de compressão isotérmica DA, o sistema rejeita ![]() de calor para a fonte fria, enquanto utiliza o trabalho recebido. Na etapa de compressão adiabática AB, o sistema não realiza trocas de calor com o ambiente. Nessa etapa, o sistema recebe trabalho, o qual é convertido em aumento de sua energia interna e, consequentemente, de sua temperatura.
de calor para a fonte fria, enquanto utiliza o trabalho recebido. Na etapa de compressão adiabática AB, o sistema não realiza trocas de calor com o ambiente. Nessa etapa, o sistema recebe trabalho, o qual é convertido em aumento de sua energia interna e, consequentemente, de sua temperatura.
No ciclo de Carnot, os calores trocados ![]() e
e ![]() entre as fontes quente e fria, e as temperaturas absolutas
entre as fontes quente e fria, e as temperaturas absolutas ![]() e
e ![]() dessas fontes estão relacionados de acordo com a seguinte proporção:
dessas fontes estão relacionados de acordo com a seguinte proporção:
![]()
Substituindo na equação do rendimento de uma máquina térmica, obtemos, para a máquina de Carnot:
![]()
Considerando a temperatura da fonte fria a ![]() igual a zero Kelvin (zero absoluto), temos:
igual a zero Kelvin (zero absoluto), temos:
![]()
Entretanto, esse fato contraria a 2ª Lei da Termodinâmica, que estabelece a impossibilidade de um rendimento de 100% (![]() ) em qualquer máquina térmica.
) em qualquer máquina térmica.
Isso ocorre devido à necessidade de haver transferência de energia para a fonte fria, o que impede que todo o calor seja convertido em trabalho. Portanto, concluímos que nenhum sistema físico pode atingir o zero absoluto de temperatura.
De qualquer forma, podemos afirmar que:
A temperatura da fonte fria de uma máquina ideal de Carnot, operando com rendimento de 100%, seria o zero absoluto.
Referências:
Curso de Física Básica: Fluidos, Oscilações e Ondas, Calor (Volume 2)