Saiba o que são os gases perfeitos
Neste artigo, vamos mergulhar na compreensão dos Gases Perfeitos e suas propriedades fundamentais. Explorando como as leis que regem esses gases são cruciais para compreender seu comportamento termodinâmico.
Por – Redação do Física Curiosa
A teoria dos gases perfeitos é fundamental na Física e termodinâmica, descrevendo o comportamento simplificado de gases em condições específicas.
Apesar de não se aplicar a todos os gases reais, fornece a base para compreender princípios básicos.
SAIBA+ 10 Experimentos de Física que você pode fazer
Introdução
Os gases perfeitos são chamados assim porque são descritos teoricamente de maneira “perfeita”. Na teoria cinética dos gases perfeitos, as moléculas do gás não exercem forças umas sobre as outras, exceto quando colidem, e que as colisões são completamente elásticas, ou seja, sem perda de energia cinética.
Além disso, assume-se que as moléculas são pontos sem volume e suas dimensões são desprezíveis em relação às dimensões do recipiente que contém o gás. Essa teoria é útil para entender o comportamento dos gases perfeitos em muitas situações, apesar de nenhum gás real se comportar exatamente como um gás perfeito.
continua após a publicidade
Correção: O ar que respiramos é geralmente o primeiro exemplo de gás que nos vem à mente. Este ar compõe a atmosfera da Terra, que é uma mistura de vários gases, principalmente nitrogênio (78%) e oxigênio (21%). No entanto, o ar não é considerado um gás perfeito devido às suas características peculiares, tais como a presença de vapor de água, dióxido de carbono e outros gases em quantidades variáveis.
Devido à gravidade e ao campo magnético do nosso planeta, esses gases são atraídos para formar uma fina camada, com cerca de 99% da atmosfera contida em uma faixa que se estende da superfície terrestre a pouco mais de 30 km de altitude. Esta camada gasosa é fundamental para a vida, pois contém oxigênio e filtra grande parte das radiações nocivas para os seres vivos, como a radiação ultravioleta.

Alguns seres vivos consomem o oxigênio através da respiração e expelem um subproduto, o dióxido de carbono, que é então absorvido pelas plantas. Por meio da fotossíntese, as plantas transformam o dióxido de carbono em oxigênio. A pressão atmosférica produzida pelo peso da atmosfera sobre a superfície da Terra evita que a água líquida dos oceanos, mares, rios e lagos se transforme rapidamente em vapor.
Os gases deixam o céu azul
Os gases presentes em nossa atmosfera são também responsáveis pela cor azul do céu. A luz branca do sol, ao atingir as partículas gasosas, sofre dispersão, separando-se nas cores do arco-íris. A luz azul é a que se dispersa mais em todas as direções, predominando sobre as outras cores.
Os gases sempre estiveram presentes em nossas vidas diárias. No entanto, a partir do século XVII, vários cientistas iniciaram estudos sobre as propriedades dos gases e perceberam que seria necessário simplificar, uma vez que nem todos os gases apresentavam comportamento uniforme. Surgiu então o modelo teórico do gás perfeito ou gás ideal, que será útil para estudos posteriores. A seguir, faremos uma análise desse modelo.
SAIBA+ Veja as diferenças entre a velocidade da luz e a velocidade do som
As variáveis de estado dos gases perfeitos
Ao considerar uma massa de gás, estabelecemos uma quantidade N de partículas desse gás, sendo que este número N é sempre muito grande, da ordem de ![]() partículas por centímetro cúbico. No local onde você está, existem aproximadamente
partículas por centímetro cúbico. No local onde você está, existem aproximadamente ![]() moléculas dos componentes do ar (oxigênio, hidrogênio, nitrogênio, entre outros) em cada centímetro cúbico.
moléculas dos componentes do ar (oxigênio, hidrogênio, nitrogênio, entre outros) em cada centímetro cúbico.
É comum quantificar uma porção de gás por meio do seu número de mols (n), por ser mais conveniente. Um mol de gás é composto por um número de moléculas desse gás, que é dado pelo número de Avogadro (A = ![]() moléculas/mol). O número de mols é obtido dividindo-se a massa do gás (m) pela sua massa molar ou massa molecular em gramas (M), ambos expressos na mesma unidade.
moléculas/mol). O número de mols é obtido dividindo-se a massa do gás (m) pela sua massa molar ou massa molecular em gramas (M), ambos expressos na mesma unidade.
![]()
SAIBA+ Entenda o que é calor Latente e como ele influencia nos materiais.
Temperatura
para uma massa de gás perfeito, as variáveis de estado são a temperatura (T), o volume (V) e a pressão (p). A temperatura está intimamente relacionada com a energia cinética de translação das partículas do gás. Para medir a temperatura em Kelvin, utilizamos o símbolo T. É importante lembrar que:
(1) ![]()
Volume
Os gases possuem alta capacidade de expansão, o que significa que suas moléculas ocupam todo o espaço disponível no recipiente que os contém. Dessa forma, o volume ocupado pelo gás corresponde à capacidade do recipiente que o contém.
As unidades de volume mais comuns que iremos encontrar são o metro cúbico (m³) e o litro (L). Lembre-se:
![]()
SAIBA+ Aprenda Física com o futebol
Pressão
A definição de pressão é uma grandeza escalar que se obtém a partir da razão entre a intensidade da força resultante, aplicada perpendicularmente a uma superfície, e a área dessa superfície. Quando uma força resultante normal de módulo F é aplicada em uma superfície de área A, a pressão na superfície pode ser calculada pela fórmula:
![]()
Existem diversas unidades de medida para a pressão, sendo as mais comuns o pascal (Pa), a atmosfera técnica métrica (atm), a atmosfera normal (At) e o milímetro de mercúrio (mmHg). As equivalências entre essas unidades de medida são as seguintes:
![]()
![]()
![]()
As grandezas físicas temperatura, volume e pressão são consideradas as variáveis de estado de um gás perfeito, e juntas definem o comportamento macroscópico do gás. Essas variáveis estão relacionadas pelas leis dos gases ideais, que descrevem a relação entre a pressão, o volume e a temperatura de um gás.
continua após a publicidade
Lei de Boyle
A lei de Boyle, também conhecida como lei de Boyle-Mariotte, estabelece que, a uma temperatura constante, o volume ocupado por uma certa quantidade de um gás é inversamente proporcional à pressão a que esse gás é submetido.
Em outras palavras, se a pressão exercida sobre um gás é aumentada, o seu volume diminui, e se a pressão é reduzida, o seu volume aumenta. A lei é expressa matematicamente pela equação:
![]()
Onde ![]() representa a pressão do gás e
representa a pressão do gás e ![]() representa o seu volume e
representa o seu volume e ![]() é uma constante que depende da massa. Isso significa que, se a temperatura for mantida constante, para aumentar a pressão de um gás em duas vezes, precisamos reduzir o seu volume pela metade.
é uma constante que depende da massa. Isso significa que, se a temperatura for mantida constante, para aumentar a pressão de um gás em duas vezes, precisamos reduzir o seu volume pela metade.
Nessas transformações, a massa e a temperatura do gás perfeito permanecem constantes. Isso significa que a quantidade de gás e a sua temperatura não mudam durante a transformação.
![]()
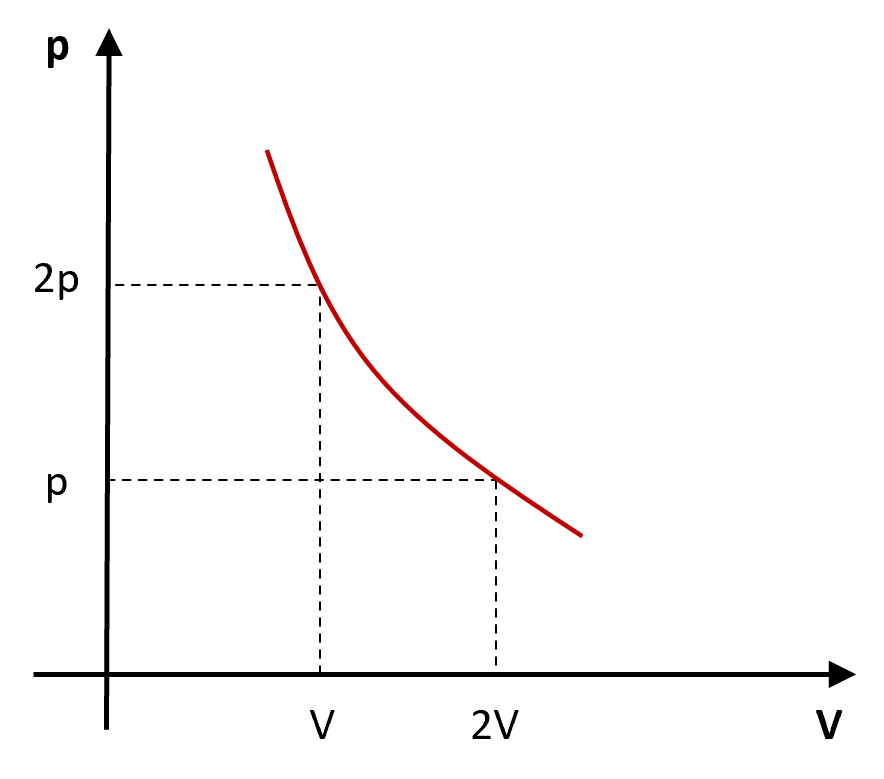
Em um diagrama pressão (![]() ) versus volume (
) versus volume (![]() ), a representação gráfica da Lei de Boyle é uma curva chamada de hipérbole, que descreve a relação inversa entre a pressão e o volume de um gás perfeito mantido a uma temperatura constante.
), a representação gráfica da Lei de Boyle é uma curva chamada de hipérbole, que descreve a relação inversa entre a pressão e o volume de um gás perfeito mantido a uma temperatura constante.
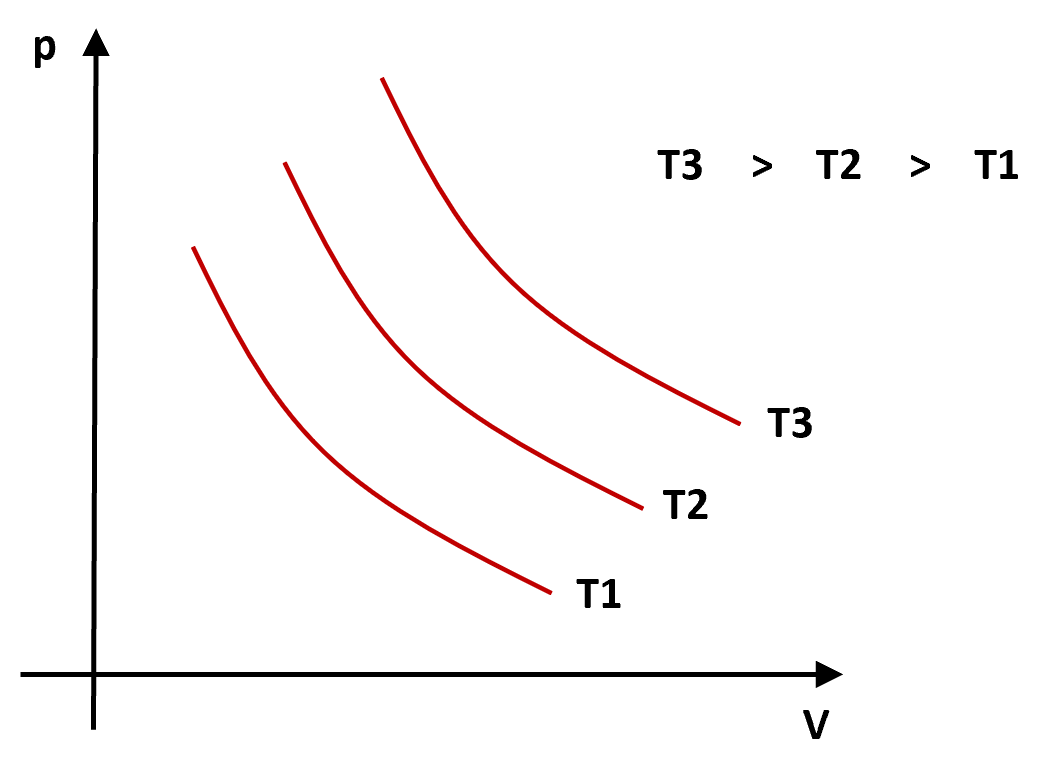
Podemos observar que para diferentes valores da temperatura absoluta do gás, a curva que representa a relação entre pressão e volume é diferente, sendo uma hipérbole em cada caso. Além disso, quanto maior a temperatura do gás, mais distante da origem dos eixos se encontra a curva hipérbole correspondente.
Lei de Charles e Gay-Lussac
Lei de Charles e Gay-Lussac, também conhecida como Lei de Gay-Lussac, é uma lei da termodinâmica que descreve a relação entre o volume e a temperatura de um gás mantido a pressão constante.
Segundo essa lei, a uma pressão constante, o volume ocupado por uma certa quantidade de gás é diretamente proporcional à sua temperatura absoluta (medida em Kelvin). Ou seja, se a temperatura do gás aumenta, o volume ocupado pelo gás também aumenta, e vice-versa.
Quando uma determinada massa de gás perfeito sofre uma transformação isobárica (ou seja, mantendo a pressão constante), seu volume varia diretamente proporcional à sua temperatura absoluta. Essa relação é conhecida como Lei de Charles e Gay-Lussac
A relação matemática da Lei de Charles e Gay-Lussac é expressa pela seguinte equação:
![]()
onde ![]() é o volume ocupado pelo gás,
é o volume ocupado pelo gás, ![]() é a temperatura absoluta e
é a temperatura absoluta e ![]() é uma constante que depende da massa, da pressão e da natureza do gás, sendo inversamente proporcional ao valor da pressão, a qual permanece constante.
é uma constante que depende da massa, da pressão e da natureza do gás, sendo inversamente proporcional ao valor da pressão, a qual permanece constante.
continua após a publicidade
Uma maneira de manter a pressão de um gás perfeito constante é aumentar a capacidade do recipiente que o contém proporcionalmente ao aumento da temperatura absoluta. Por exemplo, se a temperatura absoluta do gás for dobrada, então a capacidade do recipiente também deve ser dobrada. É importante tomar essas medidas para garantir que o gás não seja comprimido ou expandido excessivamente, o que poderia afetar sua pressão.
Durante essas transformações em um gás perfeito, é mantida a constância de sua massa e pressão. Portanto, a Lei de Charles e Gay-Lussac assegura que a relação em questão permaneça válida:
![]()
A representação gráfica da Lei de Charles e Gay-Lussac em um diagrama volume (![]() ) versus temperatura (
) versus temperatura (![]() ou
ou ![]() ) é uma linha reta inclinada em relação aos eixos.
) é uma linha reta inclinada em relação aos eixos.
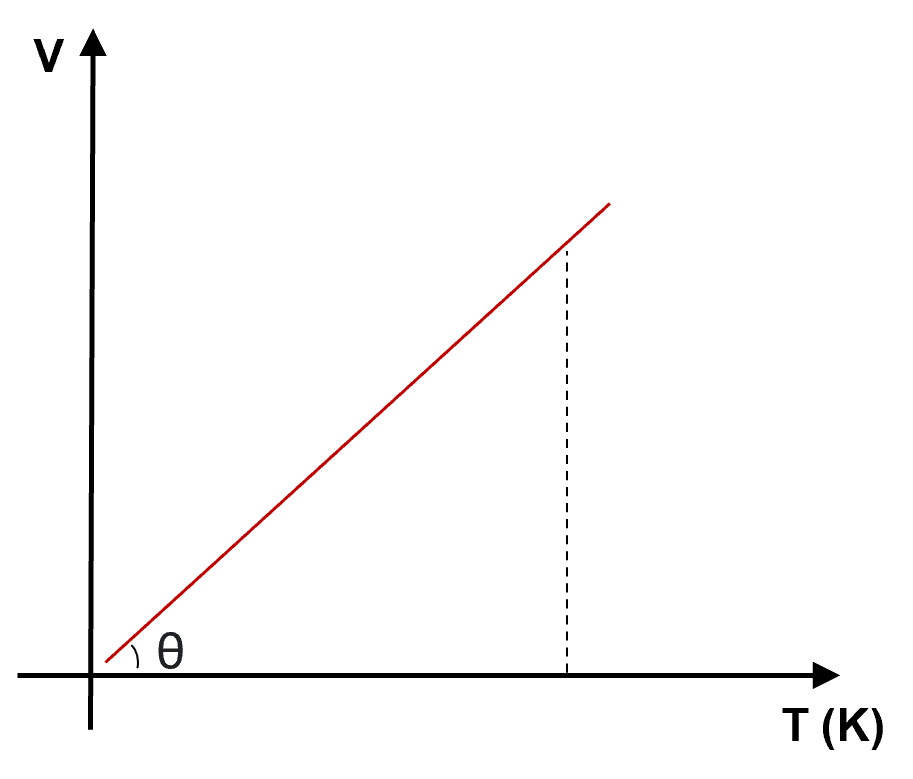
 ) a pressão constante
) a pressão constantePodemos destacar que o gás perfeito é um modelo teórico formado por partículas que possuem um volume insignificante e, em uma temperatura que corresponde ao zero absoluto, o volume deste gás praticamente se torna nulo.
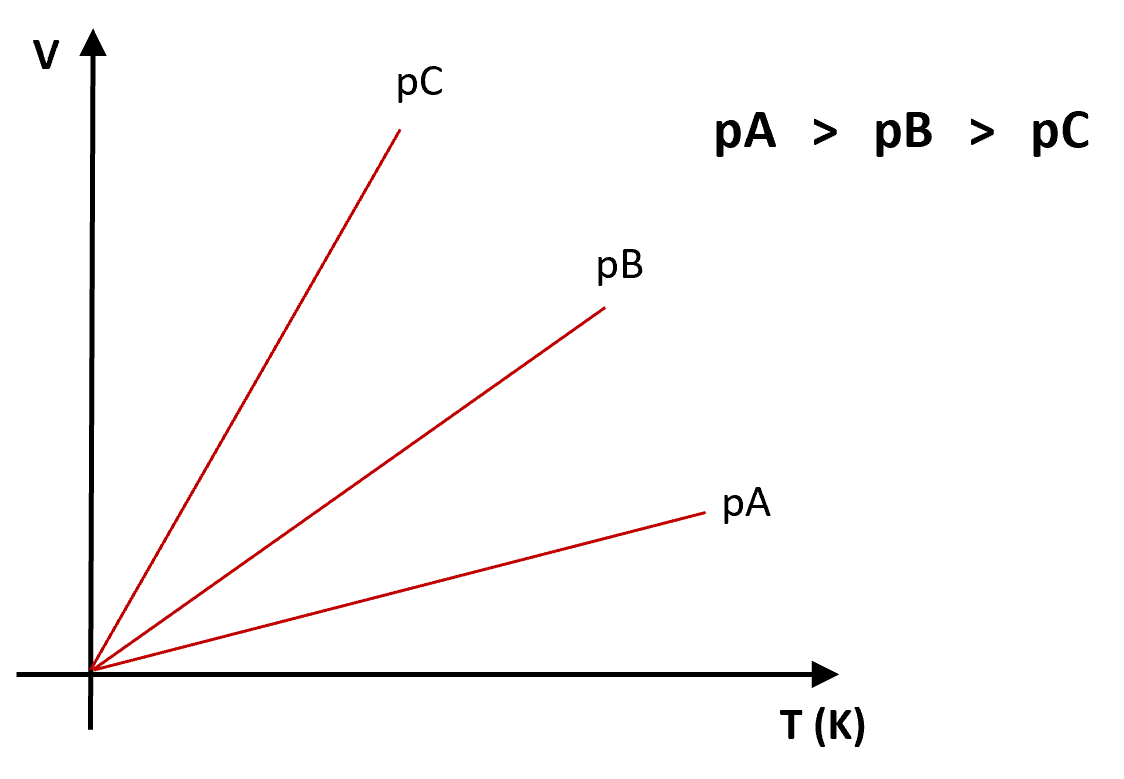
Para três pressões diferentes, ![]() ,
, ![]() ,
, ![]() , sendo
, sendo ![]() . Representando graficamente, quanto menor ângulo de declividade
. Representando graficamente, quanto menor ângulo de declividade ![]() , maior a pressão:
, maior a pressão:
Lei de Charles
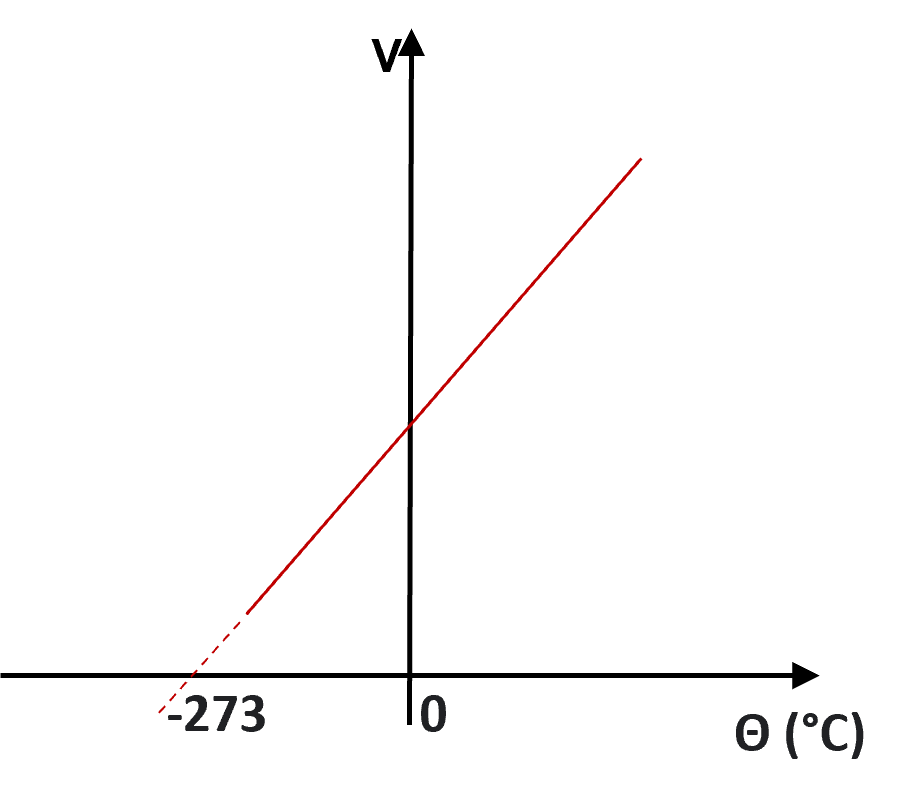
Em 1787, o físico francês Jacques Alexandre Cesar Charles (1746-1823) descobriu que, a pressão constante, a variação de volume de um gás é proporcional à variação de sua temperatura.
Embora tenha chegado a essa conclusão, Charles não publicou suas descobertas, e foi apenas em 1802 que Gay-Lussac chegou à mesma conclusão. Durante seus experimentos, Charles observou que todas as substâncias no estado gasoso, mantidas a pressão constante, tinham seu volume variando em ![]() do volume ocupado por esse gás a 0°C, a cada 1°C de aumento na temperatura.
do volume ocupado por esse gás a 0°C, a cada 1°C de aumento na temperatura.
Essa observação levou Charles a concluir que, a -273°C, o volume de qualquer gás provavelmente se anularia. Essa temperatura foi posteriormente utilizada por Lord Kelvin na definição do zero absoluto. Charles também estabeleceu a relação direta entre as variações de pressão e temperatura, a volume constante, de um gás.
Essa lei estabelece que, para uma massa fixa de gás mantida a volume constante, a pressão do gás é diretamente proporcional à sua temperatura absoluta. Ou seja, se a temperatura do gás aumentar, sua pressão também aumentará, e se a temperatura diminuir, sua pressão diminuirá. Matematicamente, a Lei de Charles pode ser representada pela equação:
![]()
onde p é a pressão do gás, T é a temperatura absoluta e K_{3} uma constante que depende da massa, do volume e da natureza do gás, sendo inversamente proporcional ao valor do volume, que permanece constante. Durante essas transformações, o gás perfeito mantém a constância de sua massa e volume. Consequentemente, a Lei de Charles assegura a precisão da seguinte relação:
![]()
É importante destacar que a Lei de Charles só é válida para gases ideais, que obedecem a todas as leis dos gases perfeitos e apresentam comportamento uniforme sob as mesmas condições.
em um diagrama pressão (![]() ) versus temperatura (
) versus temperatura (![]() ou
ou ![]() ) é uma linha reta inclinada em relação aos eixos.
) é uma linha reta inclinada em relação aos eixos.
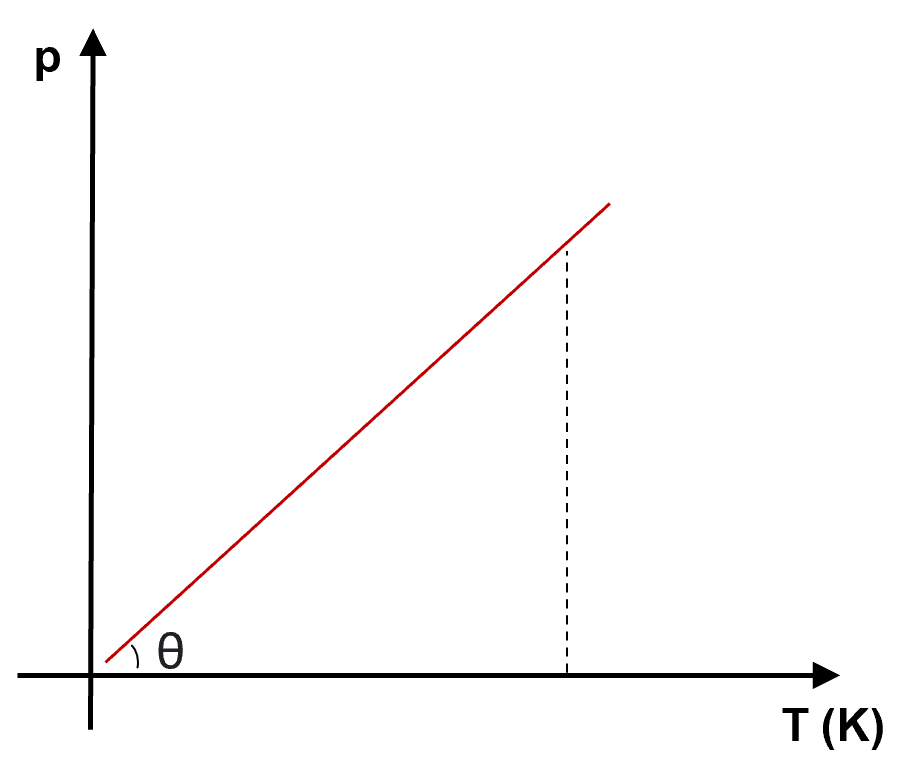
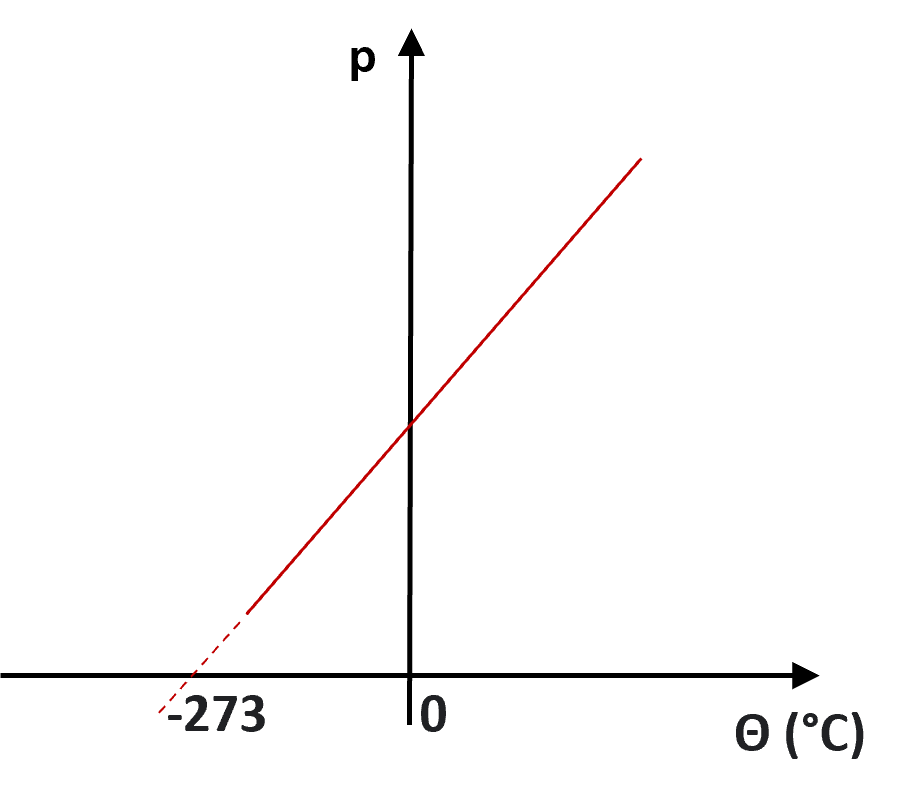
 ) a volume constante
) a volume constantePara três volumes diferentes, ![]() ,
, ![]() ,
, ![]() , sendo
, sendo ![]() . Representando graficamente, quanto menor ângulo de declividade
. Representando graficamente, quanto menor ângulo de declividade ![]() , maior o volume:
, maior o volume:
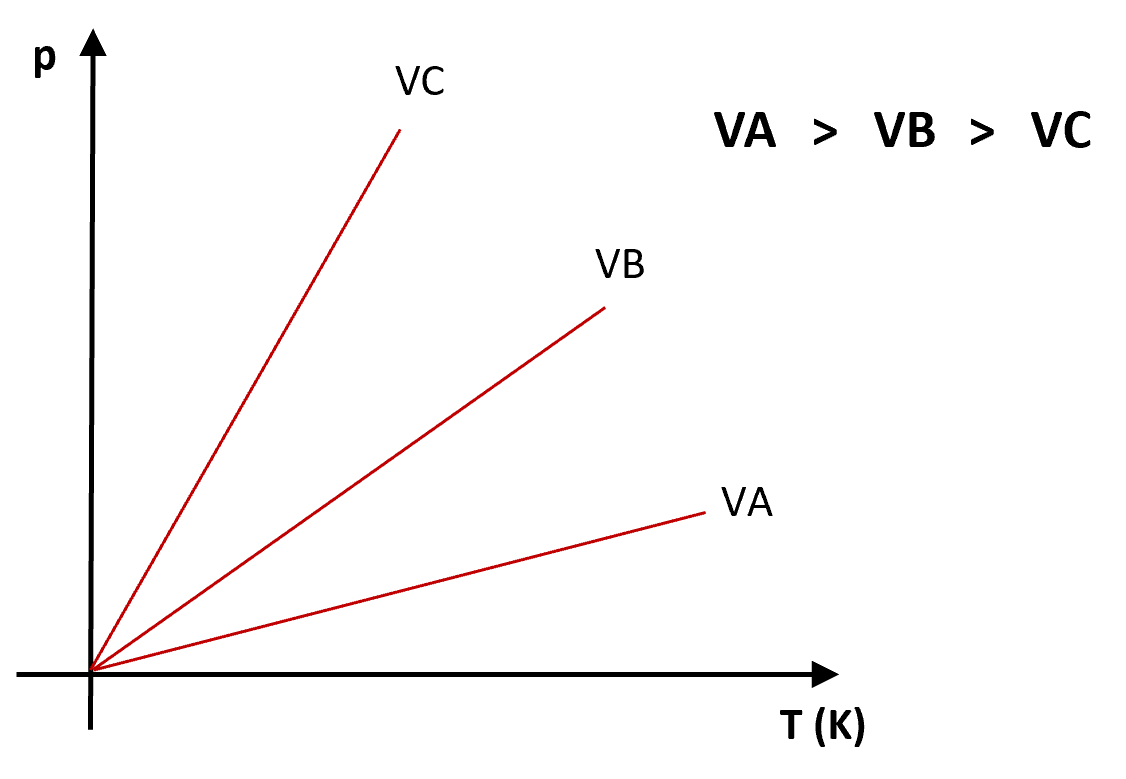
SAIBA+ Entenda o que é calor Latente e como ele influencia nos materiais.
Equação de Clapeyron
Clapeyron juntou as leis de Boyle, Gay-Lussac e Charles a respeito de gases perfeitos, sintetizando e chegando à expressão que leva seu nome, a famosa Equação de Clapeyron.
Essa equação é fundamental para a compreensão do comportamento dos gases perfeitos e sua relação com a pressão, volume, temperatura e número de mols. Sendo expressada através da seguinte equação matemática:
![]()
em que p representa a pressão, V é o volume, n é o número de mols, R é a constante dos gases perfeitos e T é a temperatura absoluta.
A constante universal dos gases perfeitos (R) e seus valores
Sob as condições normais de temperatura e pressão (CNTP), que consistem em uma temperatura de 0°C e uma pressão de 1,0 atm, o volume ocupado por 1 mol de qualquer gás é de 22,4 litros.
Essa relação é conhecida como volume molar e é uma constante que se aplica a todos os gases perfeitos nessas mesmas condições de temperatura e pressão. Portanto, da Equação de Clapeyron, temos:
![]()
Substituindo os dados anteriores, obtemos:
![]()
continua após a publicidade
A constante física R é invariante e possui um valor numérico constante. No entanto, a unidade de medida utilizada para expressar as demais grandezas pode afetar o valor numérico de R. Dessa forma, a constante R pode assumir diferentes valores, dependendo das unidades utilizadas para as outras grandezas na equação em que R aparece. Por exemplo:
![]()
Em resumo, a equação de Clapeyron pode ser usada para calcular a variação de uma das grandezas quando as outras são alteradas.
Por exemplo, se a pressão e o volume de gases perfeitos forem mantidos constantes, um aumento na temperatura levará a um aumento na quantidade de mols de gases perfeitos, de acordo com a Lei de Clapeyron.
A Lei de Clapeyron é amplamente utilizada em áreas como a Física, a Química e a Engenharia, onde é necessário compreender e controlar o comportamento dos gases perfeitos em diferentes situações. A contribuição de Clapeyron para a Termodinâmica foi tão significativa que sua equação é lembrada até hoje como uma das leis fundamentais dessa área da ciência.