Entenda o que é energia térmica e calor sensível
Neste artigo, vamos explorar o conceito de energia térmica e calor sensível, abordando como esses fenômenos ocorrem e como eles afetam os sistemas e objetos ao nosso redor.
A energia térmica e o calor sensível são conceitos fundamentais na área da Física e termodinâmica.
A energia térmica está relacionada ao movimento das partículas em um sistema, enquanto o calor sensível representa a quantidade de energia necessária para aumentar ou diminuir a temperatura de um corpo sem que ocorra mudança de fase.
SAIBA+ Veja quais são os 05 estados da matéria
Introdução
Quando há troca de energia térmica entre corpos, é possível observar mudanças na temperatura ou no estado físico do objeto em questão. A variação na temperatura está relacionada à agitação das partículas do corpo, sendo essa energia térmica denominada como calor sensível.
Já a mudança no estado físico ocorre devido à alteração no estado de agregação das partículas, fazendo com que um sólido, por exemplo, se torne líquido. Nesse caso, a energia térmica envolvida é chamada de calor latente.

É fundamental compreender a distinção entre calor e temperatura. Calor refere-se à energia térmica que flui entre dois pontos que possuem temperaturas distintas.
Por sua vez, temperatura é o estado termodinâmico de um corpo que reflete o nível médio de agitação das partículas que o compõem. É importante ressaltar que esses conceitos não são sinônimos, uma vez que a temperatura não é a energia térmica em si, mas sim uma medida da agitação das partículas de um corpo.
SAIBA+ Conheça as 04 forças da natureza
Entenda a diferença entre Capacidade Térmica (C) e Calor Específico (c)
Ao fornecermos uma quantidade de calor ![]() a um corpo de massa
a um corpo de massa ![]() e temperatura inicial
e temperatura inicial ![]() , sua temperatura aumenta para
, sua temperatura aumenta para ![]() devido à transferência de energia térmica.
devido à transferência de energia térmica.
A variação de temperatura (![]() ) é dada por,
) é dada por, ![]() , ou seja, é a diferença entre a temperatura final e a inicial. Define-se capacidade térmica (C) ou capacidade calorífica desse corpo como:
, ou seja, é a diferença entre a temperatura final e a inicial. Define-se capacidade térmica (C) ou capacidade calorífica desse corpo como:
(1) ![]()
A unidade usual de capacidade térmica é a caloria por grau Celsius (![]() )
)
Essa unidade indica a quantidade de calor necessária para elevar a temperatura de 1 grama de uma substância em 1 grau Celsius (![]() ). Outras unidades de capacidade térmica também podem ser utilizadas, como joule por kelvin (
). Outras unidades de capacidade térmica também podem ser utilizadas, como joule por kelvin (![]() ) no sistema internacional de unidades (SI).
) no sistema internacional de unidades (SI).
continua após a publicidade
A capacidade térmica (C) de um corpo indica a quantidade de calor que ele precisa receber ou ceder para que sua temperatura varie uma unidade
Por exemplo, suponha que um corpo precise receber 100 calorias de energia térmica para que sua temperatura aumente em 5,0 °C. Dividindo o primeiro valor pelo segundo, encontraremos para a capacidade térmica desse corpo o valor 20 cal/°C. Isso significa que, para variar 1 °C, ele precisa receber (ou ceder) 20 calorias.
A definição da capacidade térmica por unidade de massa de um corpo é conhecida como calor específico (![]() ). O calor específico é geralmente expresso em unidades de calorias por grama grau Celsius (
). O calor específico é geralmente expresso em unidades de calorias por grama grau Celsius (![]() ).
).
(2) ![]()
O calor específico (![]() ) é uma grandeza que indica a quantidade de calor necessária para que cada unidade de massa de um corpo sofra uma variação de temperatura de uma unidade.
) é uma grandeza que indica a quantidade de calor necessária para que cada unidade de massa de um corpo sofra uma variação de temperatura de uma unidade.
Se o corpo do exemplo anterior (cuja capacidade térmica é ![]() ) tivesse
) tivesse ![]() de massa, seu calor específico seria
de massa, seu calor específico seria ![]() . Para esse cálculo, divide-se a capacidade térmica pela massa do corpo:
. Para esse cálculo, divide-se a capacidade térmica pela massa do corpo:
![]()
Portanto, a capacidade térmica depende da massa do corpo, enquanto o calor específico é uma propriedade intrínseca da substância.
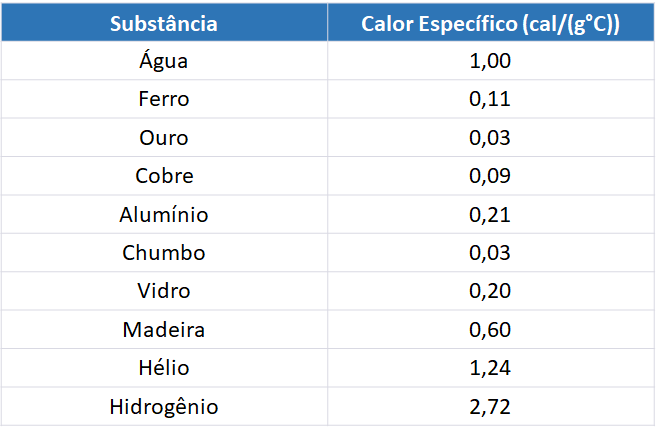
A água é frequentemente utilizada como exemplo em exercícios de termodinâmica, devido à sua importância e abundância na natureza. Seu calor específico é de aproximadamente 1,0 cal/g °C, o que significa que para elevar a temperatura de um grama de água em um grau Celsius é necessário fornecer 1,0 caloria de energia térmica.
A tabela a seguir apresenta o calor específico de algumas substâncias:
Como calcular o calor Sensível?
O calor sensível é uma forma de energia térmica que, ao ser transferida para um corpo ou dele retirada, provoca uma variação na temperatura do mesmo.
O cálculo da quantidade de calor sensível que um corpo recebe ou cede pode ser feito utilizando a definição de calor específico sensível, que é a quantidade de calor necessária para elevar a temperatura de uma unidade de massa de determinada substância em um grau Celsius (ou Kelvin).
![]()
A equação em questão é conhecida como a Equação Fundamental da Calorimetria
Lembre-se que a variação de temperatura é dada por: ![]()
SAIBA+ Aprenda Física com o futebol
O que é um sistema físico termicamente isolado?
Na natureza, existe uma regra que os objetos gostam de ter a mesma temperatura do ambiente em que estão. Isso significa que, quando algo está muito quente, ele passa o calor para algo mais frio até que fiquem com a mesma temperatura.
Isso é importante porque ajuda a entender como funcionam várias coisas que usamos no dia a dia, como o ar-condicionado, o chuveiro e até mesmo o nosso corpo!
Existem situações em que é desejável evitar as trocas de calor entre o sistema físico e o meio externo. Isso pode ser alcançado por meio de um sistema termicamente isolado, no qual a transferência de calor é minimizada ou até mesmo eliminada.
continua após a publicidade
Em outras palavras, um sistema termicamente isolado é um sistema que foi projetado para evitar que o calor saia ou entre no sistema, mantendo a temperatura interna constante. Alguns exemplos de sistemas termicamente isolados incluem garrafas térmicas, geladeiras, freezers e câmaras frigoríficas, que são essenciais para manter alimentos e medicamentos em boas condições de armazenamento.

Em um sistema termicamente isolado, a transferência de calor só ocorre entre os corpos que fazem parte do sistema. Isso significa que, quando um corpo perde energia térmica, essa energia é recebida pelos outros corpos que estão dentro do sistema, mantendo a temperatura do ambiente constante, valendo a relação:
![]()
A soma das quantidades de calor cedidas por alguns corpos em um sistema é igual em módulo à soma das quantidades de calor recebidas pelos outros corpos no mesmo sistema. Essa relação também pode ser escrita como a soma das quantidades de calor recebidas pelos corpos é igual em módulo à soma das quantidades de calor cedidas pelos mesmos. O uso do módulo na fórmula é necessário porque o calor recebido é considerado positivo e o calor cedido é considerado negativo. Podemos reescrever a relação:
![]()
Calorímetro
Para realizar a mistura térmica de dois ou mais corpos, especialmente quando um deles está no estado líquido, é necessário um recipiente adequado, conhecido como calorímetro.
Este tipo de recipiente pode ter aparatos que permitem a obtenção direta ou indireta do valor das quantidades de calor trocadas entre os corpos.
Calorímetro é um recipiente usado para medir a quantidade de calor envolvida em uma reação química ou em processos de troca de calor, e pode ser utilizado para determinar a capacidade térmica de um objeto ou substância.
Geralmente, os calorímetros são feitos de metal, como alumínio ou cobre, e são isolados termicamente por um revestimento de isopor. Na tampa, também de isopor, há um orifício para a introdução do termômetro, que indica a temperatura da mistura em observação.
SAIBA+ Entenda como a lua afeta os oceanos
Embora o calorímetro seja usado como recipiente, ele também participa das trocas de calor, cedendo calor para o conteúdo ou recebendo calor dele.
Quando um calorímetro é ideal, significa que impede as trocas de calor entre seu conteúdo e o meio externo, além de não trocar calor com os corpos dentro dele.
No entanto, esse tipo de calorímetro só existe na teoria e é utilizado frequentemente em exercícios, sendo descrito como tendo capacidade térmica desprezível.
Em experimentos que requerem tratamento especial, são utilizados calorímetros mais sofisticados do que aquele comumente utilizado em laboratórios escolares.
Conclusão
Em resumo, a energia térmica e o calor sensível são conceitos fundamentais para compreender o comportamento térmico das substâncias.
A energia térmica refere-se à energia total contida em um sistema, resultante da agitação das partículas que o compõem. É uma medida da energia cinética das partículas em movimento, incluindo a vibração, rotação e translação. Quanto maior a energia térmica de um sistema, mais agitadas estão suas partículas.
continua após a publicidade
Por sua vez, o calor sensível é a energia transferida entre corpos de diferentes temperaturas. Esse processo ocorre quando há uma diferença de temperatura entre dois corpos e ocorre uma transferência de energia térmica do corpo com maior temperatura para o corpo com menor temperatura.
O calor sensível resulta em mudanças na temperatura dos corpos envolvidos, sem que haja uma mudança de fase, ou seja, sem que ocorra a transformação da substância de sólido para líquido ou de líquido para gasoso.
Esses conceitos são de extrema importância em diversas áreas, como na engenharia, na climatização de ambientes, na indústria alimentícia e na produção de energia.
Ao compreender a energia térmica e o calor sensível, é possível analisar e controlar melhor os sistemas térmicos, maximizando a eficiência energética e promovendo o desenvolvimento de tecnologias mais sustentáveis.
Além disso, esses conceitos são essenciais para entender fenômenos cotidianos, como o resfriamento de bebidas, o aquecimento de ambientes e o funcionamento de sistemas de refrigeração e climatização.